Enzyme sind chemische Stoffe des Körpers und sind an einer Vielzahl von Stoffwechselprozessen beteiligt.
Enzyme
Definition
Enzyme sind chemische Stoffe, die im ganzen Körper zu finden sind. Sie setzen chemische Reaktionen im Körper in Gang.
Historie
Das Wort Enzym wurde von Wilhelm Friedrich Kühne 1878 eingeführt und leitet sich aus dem griechischen Kunstwort enzymon ab, welches Hefe oder Sauerteig bedeutet. Dieser hielt dann Einzug in die internationale Wissenschaft. Die international union of pure applied chemistry (IUPAC) und die international union of biochemstry (IUBMB) erarbeiteten zusammen eine Nomenklatur der Enzyme, die die Vertreter dieser großen Gruppe der Stoffe als eine gemeinsame Gruppe definiert. Wichtig für die Bestimmung der Aufgaben der einzelnen Enzyme ist die Namensgebung, die die Enzyme nach ihren Aufgaben klassifiziert.
Abbildung von Enzymen
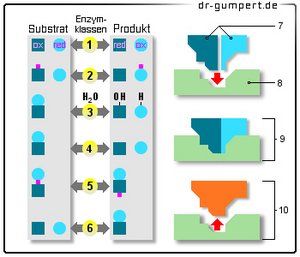
Enzyme
6 Enzymklassen:
- Oxidoreduktasen
(Oxidation/Reduktion) - Transferasen
(Übertragung) - Hydrolasen
(Einsatz vom Wasser) - Lyasen
(Spaltung) - Isomerasen
(gleiche Summenformel) - Ligasen
(Additionsreaktionen) - Substrate
- Aktives Zentrum
- Enzym/Substrat
Komplex - Enzym/Produkt
Komplex
Eine Übersicht aller Abbildungen von Dr-Gumpert finden Sie unter: medizinische Abbildungen
Namensgebung
Die Namensgebung der Enzyme ist auf drei Grundprinzipien basierend. Enzymnamen die auf –ase enden beschreiben mehrere Enzyme in einem System. Der Enzymname an sich beschreibt die Reaktion, die das Enzym in Gang setzt(katalysiertert). Der Enzymname ist gleichzeitig eine Klassifikation des Enzyms. Außerdem wurde ein Codesystem, das EC-Nummern-System, entwickelt, in dem die Enzyme unter einem Zahlencode aus vier Zahlen zu finden sind. Die erste Zahl bezeichnet die Enzymklasse. Listen aller erfassten Enzyme gewährleisten ein schnelleres Auffinden des angegebenen Enzymcodes. Zwar orientieren sich die Codes an Eigenschaften der Reaktion, die das Enzym katalysiert, in der Praxis erweisen sich Zahlencodes jedoch als unhandlich. Häufiger gebraucht werden systematische, nach den oben genannten Regeln konzipierte Namen. Probleme der Nomenklatur ergeben sich etwa bei Enzymen, die mehrere Reaktionen katalysieren. Für sie existieren deshalb manchmal mehrere Namen. Einige Enzyme tragen Trivialnamen, die nicht erkennen lassen, dass es sich bei der genannten Substanz um Enzyme handelt. Da die Namen traditionell eine breite Verwendung fanden, wurden sie teilweise beibehalten.
Einteilung nach Enzymfunktion
Enzyme werden nach IUPAC und IUBMB entsprechend der von ihnen in Gang gesetzten Reaktion in sechs Enzymklassen eingeteilt:
- Oxidoreduktasen
Oxidoreduktasen setzen Redoxreaktionen in Gang. Bei dieser chemischen Reaktion gehen Elektronen von einem Reaktionspartner auf den anderen über. Es erfolgt eine Elektronenabgabe (Oxidation) des einen Stoffes und eine Elektronenaufnahme (Reduktion) durch einen anderen Stoff.
Die Formel für die katalysierte Reaktion lautet A??+B?A?+B?.
Der Stoff A gibt ein Elektron (?) ab und wird oxidiert, während der Stoff B dieses Elektron aufnimmt und reduziert wird. Deswegen heißen Redoxreaktionen auch Reduktions-Oxidations-Reaktion.
Viele Stoffwechselreaktionen sind Redoxreaktionen. So übertragen Oxygenasen ein oder mehrere Sauerstoffatome auf ihr Substrat. - Transferasen
Transferasen übertragen die funktionelle Gruppe von einem Substrat auf ein anderes. Als funktionelle Gruppe werden Atomgruppen in organischen Verbindungen bezeichnet, die die Stoffeigenschaften und das Reaktionsverhalten maßgelblich bestimmen. Chemische Verbindungen, die die gleichen funktionellen Gruppen tragen, werden aufgrund von ähnlichen Eigenschaften zu Stoffklassen zusammengefasst. Funktionelle Gruppen werden danach unterteilt werden, ob sie Heteroatome sind oder nicht. Heteroatome sind alle Atome innerhalb organischer Verbindungen, die weder Kohlenstoff noch Wasserstoff sind.
Bsp.: -OH -> Hydroxylgruppe (Alkohole) - Hydrolasen
Hydrolasen spalten in reversiblen Reaktionen unter Einsatz von Wasser die Bindungen,bzw. Ester, Esther, Peptide, Glykoside, Säureanhydride oder C-C-Bindungen. Die Gleichgewichtsreaktion lautet: A-B+H2O? A-H+B-OH.
Ein Enzym, das der Gruppe der Hydrolasen angehört, ist z.B. Alpha Galactosidase. - Lyasen
Lyasen, die auch Synthasen genannt werden katalysieren die Spaltung komplexer Produkte aus einfachen Substraten, ohne ATP abzuspalten. Das Reaktionsschema lautet A-B?A+B.
ATP ist Adenosintriphosphat und ein Nukleotid, bestehend aus dem Triphosphat des Nucleosids Adenosin (und als solches ein energiereicher Baustein der Nukleinsäure RNA). ATP ist jedoch hauptsächlich die universelle Form unmittelbar verfügbarer Energie in jeder Zelle und gleichzeitig ein wichtiger Regulator energieliefernder Prozesse. ATP wird bei Bedarf aus anderen Energiespeichern (Kreatinphosphat, Glykogen, Fettsäuren) resynthetisiert. Das ATP-Molekül besteht aus einem Adeninrest, dem Zucker Ribose und drei Phosphaten (? bis ?) in Ester- (?) bzw. Anhydridbindung (? und ?). - Isomerasen
Isomerasen beschleunigen die chemische Umwandlung von Isomeren. Isomerie ist das Auftreten von zwei oder mehreren chemischen Verbindungen mit genau gleichen Atomen (gleiche Summenformel) und Molekülmassen, die sich jedoch in der Verknüpfung oder der räumlichen Anordnung der Atome unterscheiden. Die entsprechenden Verbindungen werden Isomere genannt.
Diese Isomere unterscheiden sich in ihren chemischen oder/und physikalischen, und oft auch in ihren biochemischen Eigenschaften. Isomerie tritt vor allem bei organischen Verbindungen, aber auch bei (anorganischen) Koordinationsverbindungen auf. Die Isomerie wird in verschiedene Bereiche unterteilt. - Ligasen
Ligasen katalysieren die Bildung von Substanzen, die chemisch komplexer sind als die benutzten Substrate, allerdings im Unterschied zu den Lyasen nur unter ATP-Spaltung enzymatisch wirksam sind. Zur Bildung dieser Substanzen wird also Energie benötigt, die durch die ATP- Spaltung gewonnen wird.
Manche Enzyme sind in der Lage mehrere, zum Teil sehr unterschiedliche Reaktionen zu katalysieren. Ist dies der Fall, werden sie mehreren Enzymklassen zugerechnet.
Diese Artikel könnten Sie ebenfalls interessieren:
Einteilung nach Enzymaufbau
Nahezu alle Enzyme sind Proteine und lassen sich anhand der Proteinkettenlänge einteilen:
- Monomere
Enzyme, die aus nur einer Proteinkette bestehen - Oligomere
Enzyme, die aus mehreren Proteinketten (Monomeren) bestehen - Multienzymketten
Mehrere zusammengelagerte Enzyme, die kooperieren und sich untereinander regulieren. Diese Enzymketten katalysieren die aufeinanderfolgenden Schritte im Stoffwechsel der Zelle.
Zusätzlich gibt es noch einzelne Proteinketten, die mehrere Enzymaktivitäten enthalten, diese werden als multifunktionelle Enzyme bezeichnet.
Einteilung nach Kofaktoren
Als eine weitere Einteilung gilt die Einteilung nach der Berücksichtigung der Kofaktoren. Kofaktoren, Koenzyme und Kosubstrate sind Bezeichnungen für verschiedene Einteilungen von Stoffen, die durch ihre Interaktion mit Enzymen biochemische Reaktionen beeinflussen.
Es werden dabei organische Moleküle und auch Ionen (meist Metallionen) betrachtet.
Die reinen Protein-Enzymen bestehen ausschließlich aus Proteinen und das aktive Zentrum wird nur aus Aminosäureresten und dem Peptidrückgrat gebildetet. Aminosäuren sind eine Klasse organischer Verbindungen mit mindestens einer Carboxygruppe (–COOH) und einer Aminogruppe (–NH2).
Die Holoenzyme bestehen aus einem Proteinanteil, dem Apoenzym, sowie aus einem Kofaktor, einem niedermolekularen Molekül (kein Protein). Beide zusammen sind für die Funktion des Enzyms wichtig.
Koenzyme
Organische Moleküle als Kofaktoren werden Koenzyme genannt. Sind sie kovalent an das Apoenzym gebunden, nennt man sie prosthetische Gruppen oder Kosubstrat. Als prosthetische Gruppe bezeichnet man an ein Protein fest (meist kovalent) gebundene Nicht-Eiweiß-Komponenten mit katalytischer Wirkung.
Kosubstrate sind Bezeichnungen für verschiedene Einteilungen von Stoffen, die durch ihre Interaktion mit Enzymen biochemische Reaktionen beeinflussen. Als Biokatalysatoren, Moleküle die Reaktionen in Organismen beschleunigen, beschleunigen die Enzyme biochemische Reaktionen. Sie setzen die Aktivierungsenergie herab, die überwunden werden muss, damit es zu einer Umsetzung des Stoffes kommen kann.
Weiterführende Informationen
- DNA
- Hormone
- Der Zellkern
- Aufgabe von Enzymen im menschlichen Körper
- Was ist eine Elastase?
Eine Übersicht aller bereits veröffentlichten Themen aus dem Bereich der Innere Medizin finden Sie unter Innere Medizin A-Z.